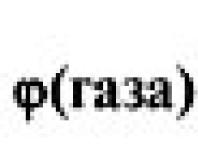Спектрофотометрические измерения концентрация растворов. Массовая и объемная доли компонентов смеси. Полные уроки — Гипермаркет знаний Что такое доля в химии
О.С.ГАБРИЕЛЯН,
И.Г.ОСТРОУМОВ,
А.К.АХЛЕБИНИН
СТАРТ В ХИМИЮ
7 класс
Продолжение. Начало см. в № 1, 2, 3, 4, 5, 6, 7/2006
Глава 2. Математика в химии
(окончание)
§ 13. Объемная доля газов в смеси
В состав воздуха входит несколько различных газов: кислород, азот, углекислый газ, благородные газы, водяные пары и некоторые другие вещества. Содержание каждого из этих газов в чистом воздухе строго определенно.
Для того чтобы выразить состав смеси газов в цифрах, т.е. количественно, используют особую величину, которую называют объемной долей газов в смеси.
Объемную долю газа в смеси обозначают греческой буквой – «фи».
Объемной долей газа в смеси называют отношение объема данного газа к общему объему смеси:
![]()
Что же показывает объемная доля газа в смеси или, как говорят, какой физический смысл этой величины? Объемная доля газа показывает, какую часть общего объема смеси занимает данный газ.
Если бы нам удалось разделить 100 л воздуха на отдельные газообразные компоненты, мы получили бы около 78 л азота, 21 л кислорода, 30 мл углекислого газа, в оставшемся объеме содержались бы так называемые благородные газы (главным образом аргон) и некоторые другие (рис. 62).
 |
Рис. 62.
|
Рассчитаем объемные доли этих газов в воздухе:

Нетрудно заметить, что сумма объемных долей всех газов в смеси всегда равна 1, или 100%:
(азота) + (кисл.) + (угл. газа) + (др. газов) = 78% + 21% + 0,03% + 0,97% = 100%.
Тот воздух, который мы выдыхаем, гораздо беднее кислородом (его объемная доля снижается до 16%), зато содержание углекислого газа возрастает до 4%. Такой воздух для дыхания уже непригоден. Вот почему помещение, в котором находится много людей, надо регулярно проветривать.
В химии на производстве чаще приходится сталкиваться с обратной задачей: определять объем газа в смеси по известной объемной доле.
Пример . Вычислите объем кислорода, содержащегося в 500 л воздуха.
Из определения объемной доли газа в смеси выразим объем кислорода:
V (кисл.) = V (возд.) (кисл.).
Подставим в уравнение числа и рассчитаем объем кислорода:
V (кисл.) = 500 (л) 0,21 = 105 л.
Кстати, для приближенных расчетов объемную долю кислорода в воздухе можно принять равной 0,2, или 20%.
При расчете объемных долей газов в смеси можно воспользоваться маленькой хитростью. Зная, что сумма объемных долей равна 100%, для «последнего» газа в смеси эту величину можно рассчитать по-другому.
Задача. Анализ атмосферы Венеры показал, что в 50 мл венерианского «воздуха» содержится 48,5 мл углекислого газа и 1,5 мл азота. Рассчитайте объемные доли газов в атмосфере планеты.
V (смеси) = 50 мл,
V (угл. газа) = 48,5 мл,
V (азота) = 1,5 мл.
Найти:
(угл. газа),
Решение
Рассчитаем объемную долю углекислого газа в смеси. По определению:
Вычислим объемную долю азота в смеси, зная, что сумма объемных долей газов в смеси равна 100%:
(угл. газа) + (азота) = 100%,
(азота) = 100% – (угл. газа) = 100% – 97% = 3%.
Ответ. (угл. газа) = 97%, (азота) = 3%.
С помощью какой величины измеряют содержание компонентов в смесях другого типа, например в растворах? Понятно, что в этом случае пользоваться объемной долей неудобно. На помощь приходит новая величина, о которой вы узнаете на следующем уроке.
1. Что такое объемная доля компонента в газовой смеси?
2. Объемная доля аргона в воздухе 0,9%. Какой объем воздуха необходим для получения 5 л аргона?
3. При разделении воздуха было получено 224 л азота. Какие объемы кислорода и углекислого газа были получены при этом?
4. Объемная доля метана в природном газе составляет 92%. Какой объем этой газовой смеси будет содержать 4,6 мл метана?
5. Смешали 6 л кислорода и 2 л углекислого газа. Найдите объемную долю каждого газа в полученной смеси.
§ 14. Массовая доля вещества в растворе
– Сколько ложечек сахара ты кладешь в чай?
– Дома – две, в гостях – восемь.
Шутка известная, но давайте посмотрим на нее глазами химика. Вряд ли вам понравится такой «чай в гостях». Уж очень сладкий он будет из-за неумеренного содержания сахара! Содержание растворенного вещества в растворе химики называют концентрацией.
Концентрацию вещества можно выражать различными способами. Кстати, число ложечек на чашку воды – способ вполне приемлемый, но только для кухни. Трудно представить себе химика, приготавливающего раствор таким образом.
Один из самых распространенных способов выражения концентрации раствора – через массовую долю растворенного вещества.
Массовой долей вещества в растворе называют отношение массы растворенного вещества к массе раствора:
Не правда ли, очень похоже на объемную долю? Так оно и есть, ведь любая доля, как вы уже знаете, – это отношение какой-то части к целому. Как и массовая доля элемента в сложном веществе, массовая доля вещества в растворе обозначается греческой буквой («омега») и может принимать значения от 0 до 1 (или от 0 до 100%). Она показывает, какая часть массы раствора приходится на растворенное вещество. И еще: массовая доля вещества в процентах численно равна массе растворенного вещества в 100 г раствора. К примеру, в 100 г 3%-го раствора уксуса содержится 3 г чистой уксусной кислоты.
Самые простые растворы состоят из двух компонентов. Один из компонентов раствора – растворитель. Для нас более привычны жидкие растворы, значит, растворитель в них – жидкое вещество. Чаще всего – вода.
Другой компонент раствора – растворенное вещество. Им может быть и газ, и жидкое, и твердое вещество.
Масса раствора складывается из массы растворителя и массы растворенного вещества, т. е. верно выражение:
m (раствора) = m (растворителя) + m (растворенного вещества).
Предположим, массовая доля растворенного вещества равна 0,1, или 10%. Значит, оставшиеся 0,9, или 90%, – это массовая доля растворителя.
Массовая доля растворенного вещества широко используется не только в химии, но и в медицине, биологии, физике, да и в повседневной жизни. В качестве иллюстрации к сказанному рассмотрим решение некоторых задач прикладного характера.
Задача 1. Перед посадкой семена томатов дезинфицируют (протравливают) 1%-м раствором марганцовки. Какую массу такого раствора можно приготовить из 0,25 г марганцовки?
(марганцовки) = 0,01 г,
m (марганцовки) = 0,25 г.
Найти:
m (раствора).
Решение
Зная массу растворенного вещества и его массовую долю в растворе, можно вычислить массу раствора:
Ответ . m (раствора) = 25 г.
Задача 2. В медицине широко применяют так называемые физиологические растворы, в частности раствор поваренной соли с массовой долей соли 0,9%. Рассчитайте массы соли и воды, необходимые для приготовления 1500 г физиологического раствора.
(соли) = 0,009,
m (раствора) = 1500 г.
Найти:
m (соли),
m (воды).
Решение
Вычислим массу соли, необходимой для приготовления 1500 г физиологического раствора:
m (соли) = m (раствора) (соли) = 1500 (г) 0,009 = 13,5 г.
Определим массу воды, необходимой для приготовления раствора:
m (воды) = m (раствора) – m (соли) = 1500 – 13,5 = 1486,5 г.
Ответ . m (соли) = 13,5 г, m (воды) = 1486,5 г.
Отличаются ли свойства растворов от свойств компонентов, образующих эти гомогенные смеси?
С помощью домашнего эксперимента (задание 9 к этому параграфу) вам будет нетрудно убедиться в том, что раствор замерзает при более низкой температуре, чем чистый растворитель. Например, морская вода начинает замерзать при температуре –1,9 °С, в то время как чистая вода кристаллизуется при 0 °С.
Что такое массовая доля растворенного вещества? Сравните понятия «объемная доля» и «массовая доля» компонентов смеси.2. Массовая доля йода в аптечной йодной настойке составляет 5%. Какую массу йода и спирта нужно взять, чтобы приготовить 200 г настойки?
3. В 150 г воды растворили 25 г поваренной соли. Определите массовую долю соли в полученном растворе.
4. В 200 г столового уксуса содержится 6 г уксусной кислоты. Определите массовую долю кислоты в столовом уксусе.
5. Найдите массу воды и лимонной кислоты, необходимую для приготовления 50 г 5%-го раствора.
6. Из 240 г 3%-го раствора питьевой соды выпарили 80 г воды. Найдите массовую долю соды в полученном растворе.
7. К 150 г 20%-го раствора сахара добавили 30 г сахара. Найдите массовую долю вещества в полученном растворе.
8. Смешали два раствора серной кислоты: 80 г 40%-го и 160 г 10%-го. Найдите массовую долю кислоты в полученном растворе.
9. Пять чайных ложек поваренной соли (с горкой) растворите в 450 г (450 мл) воды. Учитывая, что масса соли в каждой ложке примерно 10 г, рассчитайте массовую долю соли в растворе. В две одинаковые пластиковые бутылки объемом 0,5 л налейте полученный раствор и водопроводную воду. Поместите бутылки в морозильную камеру холодильника. Загляните в холодильник примерно через час. Какая жидкость начнет замерзать раньше? В какой бутылке содержимое раньше превратится в лед? Сделайте вывод.
ПРАКТИЧЕСКАЯ РАБОТА № 3.
Приготовление раствора с заданной массовой
долей
растворенного вещества
Цель данной работы состоит в приготовлении раствора с заданной массовой долей путем растворения рассчитанной массы твердого вещества в определенном объеме воды.
Рассчитайте массу твердого вещества, необходимого для приготовления раствора в соответствии с вашим вариантом задания (табл. 3). На весах отмерьте рассчитанную массу твердого вещества и перенесите его в химический стакан.
Таблица 3
Варианты задания к практической работе № 3
Рассчитайте массу воды, необходимой для приготовления раствора. Поскольку плотность воды равна 1 г/мл, рассчитанная вами масса численно равна ее объему. С помощью мерного цилиндра отмерьте вычисленный объем воды и прилейте его к веществу в стакане. Перемешивая содержимое стакана стеклянной палочкой, добейтесь полного растворения вещества в воде. Требуемый раствор готов.
§ 15. Массовая доля примесей
На примере замерзания раствора соли вы убедились, что присутствие посторонних соединений изменяет свойства вещества. В некоторых областях техники использование недостаточно «чистых» материалов недопустимо. Микросхему компьютера не сделать без особо чистого кристалла кремния, в атомной энергетике предъявляются повышенные требования к очистке ядерного топлива, световой сигнал «погаснет» в стекловолоконном кабеле, наткнувшись на посторонние вкрапления.
Если главное (основное) вещество содержит посторонние загрязнения – это тоже смесь, только в этом случае все ненужные, а порой и вредные ее компоненты называют одним словом – примеси. Чем меньше примесей, тем чище вещество.
Иногда вещество, содержащее примеси, называют техническим образцом или просто образцом. Следовательно, любой такой образец включает основное вещество и примеси.
Степень чистоты вещества принято выражать массовой долей основного компонента или массовой долей примесей.
С массовыми долями разного типа вы уже знакомы. Попробуйте теперь сами сформулировать определение, что такое массовая доля примесей в веществе. Получилось? Сравните.
Массовой долей примесей называется отношение массы примесей к массе образца:
Предположим, вам нужно вычислить массовую долю основного вещества в образце. Тогда можно воспользоваться формулой:
![]()
Следует не забывать, что сумма массовых долей основного вещества и примесей всегда равна 1, или 100%:
(осн. в-ва) + (примесей) = 1, или 100%.
Также справедливо утверждение, что масса образца складывается из массы основного вещества и массы примесей:
m (образца) = m (осн. в-ва) + m (примесей).
Разберем несколько задач с использованием понятия «массовая доля примесей».
Задача 1. Природная самородная сера содержит 8% примесей. Какая масса чистой серы содержится в 2 т природного образца?
(примесей) = 0,08,
m (образца) = 2 т.
Найти:
m (серы).
Решение
Вычислим массу примесей в 2 т самородной серы:
m (примесей) = m (образца) (примесей) = 2 (т) 0,08 = 0,16 т.
Рассчитаем массу чистой серы, содержащейся в природном образце:
m (серы) = m (образца) – m (примесей) = 2 (т) – 0,16 (т) = 1,84 т.
Ответ . m (серы) = 1,84 т.
Задача 2. В пищевой отрасли промышленности можно использовать лимонную кислоту, содержащую не более 1% посторонних примесей. В аналитической лаборатории установлено, что в 2,345 г продукта содержится 2,312 г кислоты. Можно ли использовать продукт в пищевых целях?
m (образца) = 2,345 г,
m (кислоты) = 2,312 г.
(примесей).
Решение
Вычислим массовую долю лимонной кислоты в образце:
Рассчитаем массовую долю примесей в образце:
(примесей) = 1 – (кислоты) = 1 – 0,986 = 0,014, или 1,4%.
Ответ. Данный образец лимонной кислоты не может быть использован в пищевой отрасли промышленности.
1. Что называется массовой долей примесей? Что показывает эта величина?
2. В промышленности используются вещества с маркировкой «ч», что означает «чистое вещество». Содержание примесей в них может составлять, например, 0,01%. Найдите максимально допустимую массу примесей в 120 г образца сажи с маркировкой «ч».
3. Массовая доля примесей в известняке составляет 5%. Рассчитайте массу основного вещества (карбоната кальция), содержащегося в 300 кг природного известняка.
4. При очистке медного купороса получилось 150 мг примесей, что составило 2% от массы образца. Определите массу технического медного купороса, который подвергли очистке.
5. Для изготовления полупроводниковых батарей используется сверхчистый кремний. Массовая доля примесей в нем не должна превышать 0,000 000 0001%. Годится ли для данных целей кремний, в 30 кг которого содержится 0,03 мг примесей?
Цели урока:
- Изучить понятие массовой и объемной доли компонентов смеси и научится их вычислять.
Задачи урока:
Обучающие: сформировать представление о массовой и объемной доли компонентов смеси, научить вычислять эти доли;
Развивающие: развить у учащихся умение анализировать, решать задачи, обобщать, сравнивать и делать выводы;
Воспитательные: расширение кругозора.
Основные термины:
Массовая доля – отношение массы растворенного вещества к общей массе раствора.
– отношение объема данного вещества к общему объему смеси.
Ход урока:
1. Среди приведенных объектов выберите самый маленький по размеру:
б) молекула;
в) маковое зернышко;
г) песчинка.
2. В каком ряду все перечисленные вещества относятся к простым?
а) мел, углерод, озон;
б) алмаз, кислород, гранит;
в) сера, фосфор, озон;
3. Очень важной для живой природы особенностью физических свойств воды является то, что:
а) температура кипения воды равна 100º С;
б) плотность жидкой воды выше плотности льда;
в) температура замерзания воды равна 0º С;
г) вода обладает очень низкой электропроводностью.
4. Соединений, содержащих только атомы водорода и кислорода:
а) не известно ни одного;
б) известно только одно;
в) известно несколько;
г) известно огромное количество.
5. При взаимодействии кислорода с металлами:
а) образуются соли;
б) выделяется озон;
в) образующиеся соединения всегда являются оксидами;
г) образующиеся соединения не всегда являются оксидами.
Растворы в природе.
Самые простые растворы состоят из двух компонентов. Один из компонентов раствора – растворитель. Для нас более привычны жидкие растворы, значит, растворитель в них – жидкое вещество. Чаще всего – вода.
Вы уже знаете, что природная вода никогда не бывает совершенно чистой. Так, существует вода, которая содержит значительное количество солей кальция и магния и называется жесткой (есть также мягкая вода, например дождевая). Жесткая вода дает мало пены с мылом, а на стенках котлов и чайников при ее кипячении образуется накипь. На рисунке 1 вы можете посмотреть, как жесткая вода образует накипь. Жесткость воды зависит от количества растворенных в ней солей. Содержание растворенного вещества в растворе выражают с помощью ее массовой доли.
Давайте посмотрим видео про жесткость воды:
Другой компонент раствора – растворенное вещество. Им может быть и газ, и жидкое, и твердое вещество.
В ювелирных и технических изделиях применяют не чистое золото, а его сплавы, чаще всего с медью и серебром. Чистое золото - металл слишком мягкий, ноготь оставляет на нем след. износостойкость его невелика. Проба, стоящая на золотых изделиях, изготовленных в нашей стране, означает массовую долю золота в сплаве, точнее, содержание его из расчета на тысячу массовых частей сплава. Проба 583°, например, означает, что в сплаве массовая доля золота составляет 0,583 или 58,3%.
Массовая доля.
Один из самых распространенных способов выражения концентрации раствора – через массовую долю растворенного вещества.
Отношение массы растворенного вещества к общей массе раствора называют массовой долей растворенного вещества.
Массовую долю обозначают греческой буквой «омега» и выражают в долях единицы или процентах (рисунок 2).

Рис.2. Массовая доля компонентов смеси.
Посмотрев видео
вы вникнете в понятие массовой доли и научитесь ее вычислять.
Если в 100 г раствора содержится 30 г хлорида натрия, это означает, что ω(NaCl) = 0,3 или ω(NaCl) = 30 %. Можно также сказать: «имеется тридцатипроцентный раствор хлорида натрия».
Массовая доля - самая распространенная в быту и большинстве отраслей промышленности концентрация. Именно массовая доля жира, например, указана на пакетах с молоком (посмотрите на рисунок 3).

Рис.3. Массовая доля жира в молоке.
Масса раствора складывается из массы растворителя и массы растворенного вещества, т. е.:
m(раствора) = m(растворителя) + m(растворенного вещества).
Предположим, массовая доля растворенного вещества равна 0,1, или 10%. Следовательно, оставшиеся 0,9, или 90%, – это массовая доля растворителя.
Массовая доля растворенного вещества широко используется не только в химии, но и в медицине, биологии, физике, да и в повседневной жизни. Рассмотрим решение некоторых задач, представленных на рисунке 4 и 5.

Рис.4. Задача на нахождение массовой доли.

Рис.5. Задача на нахождение массовой доли (в процентах).
В состав воздуха входит несколько различных газов: кислород, азот, углекислый газ, благородные газы, водяные пары и некоторые другие вещества. Содержание каждого из этих газов в чистом воздухе строго определенно.
Для того чтобы выразить состав смеси газов в цифрах, т.е. количественно, используют особую величину, которую называют объемной долей газов в смеси.
Аналогично массовой доле определяется и объемная доля газообразного вещества в газовой смеси, обозначаемая греческой буквой фи (рисунок 6):

Рис. 6. Объемная доля.
Объемная доля газа показывает, какую часть общего объема смеси занимает данный газ.
Если бы нам удалось разделить 100 л воздуха на отдельные газообразные компоненты, мы получили бы около 78 л азота, 21 л кислорода, 30 мл углекислого газа, в оставшемся объеме содержались бы так называемые благородные газы (главным образом аргон) и некоторые другие (рисунок 7).

Рис.7. Объемная доля благородных газов в воздухе.
Тот воздух, который мы выдыхаем, гораздо беднее кислородом (его объемная доля снижается до 16%), зато содержание углекислого газа возрастает до 4%. Такой воздух для дыхания уже непригоден. Вот почему помещение, в котором находится много людей, надо регулярно проветривать.
В химии на производстве чаще приходится сталкиваться с обратной задачей: определять объем газа в смеси по известной объемной доле.
Давайте посмотрим, как решать задачи на нахождение объемной доли (рисунок 8).

Рис.8. Задача на нахождение объемной доли.
Выводы.
1. Самые простые растворы состоят из двух компонентов. Один из компонентов раствора – растворитель. Для нас более привычны жидкие растворы, значит, растворитель в них – жидкое вещество. Другой компонент раствора – растворенное вещество. Им может быть и газ, и жидкое, и твердое вещество.
2. Один из самых распространенных способов выражения концентрации раствора – через массовую долю растворенного вещества. Отношение массы растворенного вещества к общей массе раствора называют массовой долей растворенного вещества. Массовую долю обозначают греческой буквой «омега» и выражают в долях единицы или процентах.
3. Объемная доля газа показывает, какую часть общего объема смеси занимает данный газ. Объемная доля газообразного вещества в газовой смеси обозначается греческой буквой фи.
Контролирующий блок.
1. Что такое массовая доля растворенного вещества?
2. Что такое объемная доля компонента в газовой смеси?
3. Сравните понятия «объемная доля» и «массовая доля» компонентов смеси.
4. Массовая доля йода в аптечной йодной настойке составляет 5%. Какую массу йода и спирта нужно взять, чтобы приготовить 200 г настойки?
5. Объемная доля аргона в воздухе 0,9%. Какой объем воздуха необходим для получения 5 л аргона?
6. В 150 г воды растворили 25 г поваренной соли. Определите массовую долю соли в полученном растворе.
7. При разделении воздуха было получено 224 л азота. Какие объемы кислорода и углекислого газа были получены при этом?
8. Смешали два раствора серной кислоты: 80 г 40%-го и 160 г 10%-го. Найдите массовую долю кислоты в полученном растворе.
Домашнее задание.
1. Сделайте сообщение о чистом веществе и о растворах в природе.
2. Приведите как можно больше примеров указания объемной или массовой доли вещества в растворе.
3. Придумайте по одной задаче на нахождение массовой и объемной доли вещества.
Как известно, один из самых соленых водоемов в мире - Мертвое море. В нем массовая доля поваренной соли NaCl может достигать 10 %, в то время как в Черном море - не более 1,8 %. При этом молярные концентрации этой соли составляют соответственно 3,3 моль/л и 0,5 моль/л. Таким образом, массовые доли различаются примерно в 5,5 раз, а молярности - в 6,6 раз. Это объясняется тем, что воды двух морей имеют разную плотность: у Мертвого моря она настолько велика, что в нем почти невозможно утонуть; плотность человеческого тела меньше плотности такого солевого раствора (рисунок 9).

Рис.9. Мертвое море и купание в нем.
Именно благодаря своему высокому содержанию солей мертвое море считается лечебным, как сказано в этом видео:
Список литературы:
1.Урок на тему «Массовая и объемные доли» Панина С.Г., учитель химии, СОШ №27, г. Архангельск.
2.Урок на тему «Раствор» Денисов А.Н., учитель химии, гимназия №3, г. Москва.
3.Габриелян О.С. Химия. 8 класс: контрольные и проверочные работы к учебнику О.С. Габриеляна «Химия. 8» / О.С. Габриелян, П.Н. Березкин, А.А. Ушакова и др. – М.: Дрофа, 2006.
4.Габриелян О.С. Химия . 8 класс: учебник для общеобразовательных учреждений – М.: Дрофа, 2008.
Отредактировано и выслано Борисенко И.Н.
Над уроком работали:
Панина С.Г.
Денисов А.Н.
Борисенко И.Н.
Поставить вопрос о современном образовании, выразить идею или решить назревшую проблему Вы можете на Образовательном форуме , где на международном уровне собирается образовательный совет свежей мысли и действия. Создав блог, Вы не только повысите свой статус, как компетентного преподавателя, а и сделаете весомый вклад в развитие школы будущего. Гильдия Лидеров Образования открывает двери для специалистов высшего ранга и приглашает к сотрудничеству в направлении создания лучших в мире школ.
Предмети > Химия > Химия 8 класс
Объемная доля газов в смеси
1. Ознакомьтесь, запишите определение и формулу для нахождения объемной доли газа:
В состав воздуха входит несколько различных газов: кислород, азот , углекислый газ, благородные газы, водяные пары и некоторые другие вещества. Содержание каждого из этих газов в чистом воздухе строго определенно.
Для того чтобы выразить состав смеси газов в цифрах, т. е. количественно, используют особую величину, которую называют объемной долей газов в смеси.
Объемную долю газа в смеси обозначают греческой буквой – «фи».
Объемной долей газа в смеси называют отношение объема данного газа к общему объему смеси:
![]()
Что же показывает объемная доля газа в смеси или, как говорят, какой физический смысл этой величины? Объемная доля газа показывает, какую часть общего объема смеси занимает данный газ.
Если бы нам удалось разделить 100 л воздуха на отдельные газообразные компоненты, мы получили бы около 78 л азота, 21 л кислорода, 30 мл углекислого газа, в оставшемся объеме содержались бы так называемые благородные газы (главным образом аргон) и некоторые другие (рис. 62).
|
Рис. 62. |
Рассчитаем объемные доли этих газов в воздухе:

Нетрудно заметить, что сумма объемных долей всех газов в смеси всегда равна 1, или 100%:
(азота) + (кисл.) + (угл. газа) + (др. газов) = 78% + 21% + 0,03% + 0,97% = 100%.
Тот воздух, который мы выдыхаем, гораздо беднее кислородом (его объемная доля снижается до 16%), зато содержание углекислого газа возрастает до 4%. Такой воздух для дыхания уже непригоден. Вот почему помещение, в котором находится много людей, надо регулярно проветривать.
В химии на производстве чаще приходится сталкиваться с обратной задачей: определять объем газа в смеси по известной объемной доле.
2. Рассмотрите примеры задач
Пример . Вычислите объем кислорода, содержащегося в 500 л воздуха.
Из определения объемной доли газа в смеси выразим объем кислорода:
V (кисл.) = V (возд.) (кисл.).
Подставим в уравнение числа и рассчитаем объем кислорода:
V (кисл.) = 500 (л) 0,21 = 105 л.
Кстати, для приближенных расчетов объемную долю кислорода в воздухе можно принять равной 0,2, или 20%.
При расчете объемных долей газов в смеси можно воспользоваться маленькой хитростью. Зная, что сумма объемных долей равна 100%, для «последнего» газа в смеси эту величину можно рассчитать по-другому.
Задача. Анализ атмосферы Венеры показал, что в 50 мл венерианского «воздуха» содержится 48,5 мл углекислого газа и 1,5 мл азота. Рассчитайте объемные доли газов в атмосфере планеты.
Дано:
V (смеси) = 50 мл,
V (угл. газа) = 48,5 мл,
V (азота) = 1,5 мл.
Найти:
(угл. газа),
Решение
Рассчитаем объемную долю углекислого газа в смеси. По определению:
Вычислим объемную долю азота в смеси, зная, что сумма объемных долей газов в смеси равна 100%:
(угл. газа) + (азота) = 100%,
(азота) = 100% – (угл. газа) = 100% – 97% = 3%.
Ответ. (угл. газа) = 97%, (азота) = 3%.
С помощью какой величины измеряют содержание компонентов в смесях другого типа, например в растворах? Понятно, что в этом случае пользоваться объемной долей неудобно. На помощь приходит новая величина, о которой вы узнаете на следующем уроке.
3. Выполните домашнее задание:
1. Что такое объемная доля компонента в газовой смеси?
2. Объемная доля аргона в воздухе 0,9%. Какой объем воздуха необходим для получения 5 л аргона?
3. При разделении воздуха было получено 224 л азота. Какие объемы кислорода и углекислого газа были получены при этом?
4. Объемная доля метана в природном газе составляет 92%. Какой объем этой газовой смеси будет содержать 4,6 мл метана?
5. Смешали 6 л кислорода и 2 л углекислого газа. Найдите объемную долю каждого газа в полученной смеси.
Равная отношению объёма какого-то вещества в смеси к сумме объёмов компонентов до смешивания .
Обычно обозначается греческой буквой ϕ {\displaystyle {\ce {\phi}}} .
Понятие применяется, в основном, к газам и жидкостям. В случае газов применение объемной доли удобно тем, что объёмная доля газа в смеси химически невзаимодействующих газов равна его молярной доле в этой же смеси, что достаточно точно выполняется при не слишком больших давлениях и температурах.
Определение
Объёмная доля определяется по формуле:
ϕ B = V B ∑ V i , {\displaystyle \phi _{\mathrm {B} }={\frac {V_{\mathrm {B} }}{\sum V_{i}}},}При смешивании некоторых жидкостей их суммарный объём может изменяться относительно суммы объёмов компонентов, в связи с чем не всегда корректно заменять сумму объёмов компонентов на объём раствора (смеси), например, в смесях этанола с водой.
Объёмная концентрация
Иногда используется обычно близкая по величине схожая величина, называемая объёмной концентрацией σ B {\displaystyle \sigma _{\mathrm {B} }} :
σ B = V B V , {\displaystyle \sigma _{\mathrm {B} }={\frac {V_{\mathrm {B} }}{V}},}Иногда эту величину также называют объёмной долей, поэтому рекомендуется указывать определения используемых величин для избежания разночтений. Например, в ГОСТ «Продукция алкогольная и сырьё для её производства. Метод определения объемной доли этилового спирта» под объёмной долей понимается величина, в данной статье называемая объёмной концентрацией.
Единицы измерения и обозначения
Как объёмная доля, так и объёмная концентрация, являются безразмерными величинами . Для удобства их часто выражают в процентах , иногда также используют
Смысл величины
Объёмная доля вычисляется по формуле:
,- V 1 - объём растворённого вещества в единицах объёма;
- V - общий объём раствора в тех же единицах.
Объёмная доля в химии
В химии величина используется в основном для газов, потому что объемная доля газовой смеси при н.у. равна его молярной концентрации.
Принято выражать объёмную долю в процентах.
См. также
Ссылки
Wikimedia Foundation . 2010 .
Смотреть что такое "Объёмная доля" в других словарях:
объёмная доля - — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN volume fraction …
Безразмерная физ. величина, характеризующая состав смеси и равная отношению объёма компонента смеси, приведённого к физ. условиям смеси, к объёму смеси. О. д. выражается в долях единицы, например в сотых (проценты), тысячных (промилле),… …
объёмная доля нефти в продукции скважины в данный момент времени - — Тематики нефтегазовая промышленность EN oil holdup … Справочник технического переводчика
пористость объёмная - Доля пустот в объёме мембраны. [РХТУ им. Д.И. Менделеева, кафедра мембранной технологии] Тематики мембранные технологии … Справочник технического переводчика
1) рус. ед. массы, применявшаяся до введения метрической системы мер. 1 Д. равна 1/96 золотника, или 44,434 9 мг. Д. применялась и в качестве ед. веса (1 Д.= 44,4349 мгс = = 0,435 758 мН). 2) Часть целого, например массовая доля, молярная доля,… … Большой энциклопедический политехнический словарь
Миллиардная доля единица измерения концентрации, и других относительных величин, миллиардная доля аналогична по смыслу проценту или промилле. Обозначается сокращением млрд−1 или ppb (англ. Parts per billion, читается «пи пи би»,… … Википедия
У этого термина существуют и другие значения, см. Ppm. Миллионная доля, пропромилле, (ppm) аббревиатура обозначает миллионную долю каких либо относительных величин (1 10−6 от базового показателя). Аналогична по смыслу проценту или промилле … Википедия
Концентрация величина, характеризующая количественный состав раствора. Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л … Википедия
Концентрация величина, характеризующая количественный состав раствора. Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л) … Википедия