Молекулярная физика. Свойства тел в разных агрегатных состояниях. Состояние
Энтальпия (Н) – функция состояния, приращение которой равно теплоте, полученной системой в изобарном процессе.
Термодинамическая работа и количество теплоты не являются функциями состояния, так как их значение определяется видом процесса, в результате которого система изменила своё состояние.
Внутренняя энергия тела может изменяться только в результате его взаимодействия с другими телами. Существует два способа изменения внутренней энергии: теплопередача и совершение механической работы (например, нагревание при трении или при сжатии, охлаждение при расширении).
Теплопередача - это изменение внутренней энергии без совершения работы: энергия передается от более нагретых тел к менее нагретым. Теплопередача бывает трех видов: теплопроводность (непосредственный обмен энергией между хаотически движущимися частицами взаимодействующих тел или частей одного и того же тела); конвекция (перенос энергии потоками жидкости или газа) и излучение (перенос энергии электромагнитными волнами). Мерой переданной энергии при теплопередаче является количество теплоты (Q)
Работа (W)- одна из форм обмена энергией (наряду с теплотой) термодинамической системы (физического тела) с окружающими телами; количественная характеристика преобразования энергии в физических процессах, зависит от вида процесса; работа системы положительна, если она отдает энергию, и отрицательна, если получает.
Типы термодинамических систем:
1. Изолированной системой называется такая система, которая не обменивается со средой ни веществом, ни энергией (∆m=0, ∆E=0)
2. Закрытой системой называется такая система, которая не обменивается со средой веществом, но может обмениваться энергией (∆m=0, ∆E≠0)
3. Открытой системой называется такая система, которая может обмениваться со средой как веществом, так и энергией (∆m≠0, ∆E≠0) – пример: живая клетка
Переход системы из одного состояния в другое называется процессом.
Типы термодинамических процессов:
· изобарный , p = const ; например нагревание песка, воды или камней под действием солнечных лучей;
· изохорный , V = const , например, скисание молока в стеклянной бутылке;
· изотермический , T = const , например, надувание воздушного шарика;
· адиабатический , когда не происходит ни выделения, ни поглощения тепла, т. е. ΔQ =0, например нагревание и остывание воздушных масс.
Стандартное состояние - в термохимии, состояние вещества, в котором оно находится при температуре 298,15 К и давлении 101,325 кПа (760 мм ртутного столба)
2. Первое начало термодинамики. Энтальпия. Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Стандартная энтальпия реакции. Закон Гесса. Применение первого начала термодинамики к биосистемам.
Первое начало термодинамики представляет собой строгую количественную основу для анализа энергетики различных систем. Для его формулировки необходимо ввести следующие понятия:
Под состоянием понимают совокупность свойств системы, позволяющих определить систему с точки зрения термодинамики.
Состояние системы называется равновесным , если все свойства остаются постоянными в течение как угодно большого промежутка времени и в системе отсутствуют потоки вещества и энергии.
Если свойства системы постоянны во времени, но имеются потоки вещества и энергии, состояние называется стационарным .
Если свойства системы меняются со временем, состояние называется переходным .
Изменение внутренней энергии системы ∆Е обусловлено работой W, которая совершается при взаимодействии системы со средой, и передачей теплоты Q между средой и системой. Соотношение между этими величинами составляет содержание 1-ого начала термодинамики:
Приращение внутренней энергии системы ∆Е в некотором процессе равно теплоте Q, полученной системой, плюс работа W, совершенная над системой в этом процессе: ∆E=Q+W (все величины измеряются в Джоулях)
Энтальпия – функция состояния, приращение которой равно теплоте, полученной системой в изобарном процессе (H=E+pV, где р – давление, а V – объём системы). Изменение энтальпии (или тепловой эффект химической реакции) не зависит от пути процесса, определяясь только начальным и конечным состоянием системы. Если система каким-либо путём возвращается в исходное состояние (круговой процесс), то изменение любого её параметра, являющегося функцией состояния, равно нулю, отсюда ΔH = 0
Энтальпией образования соединения А называется изменение энтальпии системы ∆Н А, сопровождающее образование 1 моль соединения А из простых веществ.
Стандартная энтальпия сгорания - ΔH гор о, тепловой эффект реакции сгорания одного моля вещества в кислороде до образования оксидов в высшей степени окисления. Теплота сгорания негорючих веществ принимается равной нулю.
Агрегатные состояния вещества (от лат. aggrego — присоединяю) — это состояния одного и того же вещества в различных интервалах (промежутках) температур и давлений .
Агрегатными состояниями принято считать газообразное , жидкое и твердое . Самыми простыми примерами существования одного и того же вещества в этих трех агре-гатных состояниях, которые наблюдаются в повседневной жизни, являются лед, вода и водяной пар . Невидимый водяной пар всегда присутствует и в окружающем нас воздухе. Вода существует в интервале температур от 0 °С до 100 °С, лед — при температуре ниже 0 °С. При температуре выше 100 ºС и нормальном атмосферном давлении молекулы воды существуют только в газообразном состоянии — в виде водяного пара. Вода, лед и водяной пар — это одно и то же вещество с химической формулой Н 2 О .
Многие вещества в обыденной жизни мы наблюдаем только в одном из агрегатных состояний. Так, кислород в окружающем нас воздухе представляет собой газ. Но при температуре -193°С он превращается в жидкость. Охладив эту жидкость до -219 ºС, мы получим твердый кислород. И на-оборот, железо в обычных условиях твердое. Однако при температуре 1535 °С железо плавится и пре-вращается в жидкость. Над расплавленным железом будет находиться газ — пар из атомов железа.
Различные агрегатные состояния существуют у каждого вещества. Отличаются эти вещества не молекулами, а тем, как эти молекулы расположены и как движутся. Расположение молекул воды в трех агрегатных состояниях показано на рисунке:
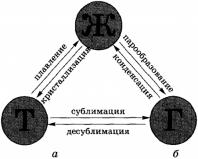
Переход из одного агрегатного состояния в другое. При определенных условиях вещества могут переходить из одного агрегатного состояния в другое. Все возможные при этом превращения отображены на рисунке:

Всего различают шесть процессов, при которых происходят агрегатные превращения вещества . Переход вещества из твердого (кристаллического) состояния в жидкое называется плавле-нием кристаллизацией , или отвердеванием . Пример плавле-ния — таяние льда, обратный процесс происходит при замерзании воды.
Переход вещества из жидкого состояния в газообразное называется парообразованием , обратный процесс называется конденсацией . Пример парообразования — испарение воды, обратный процесс можно наблюдать при выпадении росы.
Переход вещества из твердого состояния сразу в газообразное (минуя жидкое) называется сублимацией , или возгонкой , обратный процесс называется десублимацией . Например, графит можно нагреть до тысячи, двух тысяч и даже трех тысяч градусов и, тем не менее, в жидкость он не превратится: он будет сублимироваться, т. е. из твердого состояния сразу переходить в газообразное. Непосредственно в газообразное состояние (минуя жидкое) переходит и так называемый сухой лед (твердый оксид углерода СО 2 ), который можно увидеть в контейнерах для транспортировки мороженого. Все запахи, которыми обладают твердые тела (например, нафталин), также обусловлены возгонкой: вылетая из твердого тела, молекулы образуют над ним газ (или пар), обладающий запахом.
Примером десублимации является образование на окнах зимой узоров из кристалликов льда. Эти красивые узоры образуются при десублимации водяного пара, находящегося в воздухе.
Переходы вещества из одного агрегатного состояния в другое играют важную роль не только в природе, но и в технике. Так, воду, превращенную в пар, можно использовать а паровых турбинах на электростанциях. Из расплавленных металлов на заводах получают различные сплавы: сталь, чугун, латунь и т. д. Для понимания этих процессов надо знать, что происходит с вещест-вом при изменении его агрегатного состояния и при каких условиях это изменение возможно.
Определение
Агрегатные состояния вещества (от латинского aggrego -- присоединяю, связываю) -- это состояния одного и того же вещества твердое, жидкое, газообразное.
При переходе из одного состояния в другое происходит скачкообразное изменение энергии, энтропии, плотности и других характеристик вещества.
Твердые и жидкие тела
Определение
Твердыми телами называются тела, отличающиеся постоянством формы и объема.
В них межмолекулярные расстояния малы и потенциальная энергия молекул сравнима с кинетической. Твёрдые тела делятся на два вида: на кристаллические и аморфные. В состоянии термодинамического равновесия пребывают лишь кристаллические тела. Аморфные же тела по сути представляют метастабильные состояния, которые по своему строению приближаются к неравновесным, медленно кристаллизующимся жидкостям. В аморфном теле идет очень медленный процесс кристаллизации, процесс постепенного перехода вещества в кристаллическую фазу. Отличие кристалла от аморфного твёрдого тела заключается прежде всего в анизотропии его свойств. Свойства кристаллического тела зависят от направления в пространстве. Различного рода процессы, такие как теплопроводность, электропроводность, свет, звук, распространяются в различных направлениях твёрдого тела по-разному. Аморфные же тела (стекло, смолы, пластмассы) изотpопны, как и жидкости. Отличие аморфных тел от жидкостей состоит только в том, что последние текучи, в них невозможны статические деформации сдвига.
Кристаллические тела обладают правильным молекулярным строением. Именно правильному строению кристалла обязана анизотропия его свойств. Правильное расположение атомов кристалла образует так называемую кристаллическую решётку. В различных направлениях расположение атомов в решётке различно, что и ведет к анизотропии. Атомы (или ионы, или целые молекулы) в кристаллической решётке совершают беспорядочное колебательное движение около средних положений, которые и рассматриваются как узлы кристаллической решётки. Чем больше температура, тем больше энергия колебаний, а следовательно, и средняя амплитуда колебаний. В зависимости от амплитуды колебаний находится размер кристалла. Рост амплитуды колебаний ведет к росту размеров тела. Так объясняется тепловое расширение твёрдых тел.
Определение
Жидкими называют тела, которые имеют определенный объем, но не имеют упругости формы.
Жидкости отличаются сильным межмолекулярным взаимодействием и малой сжимаемостью. Жидкость занимает промежуточное положение между твёрдым телом и газом. Жидкости, как и газы, изотpопны. Кроме того, жидкость обладает текучестью. В ней, как и в газах, отсутствуют касательные напряжения (напряжения на сдвиг) тел. Жидкости тяжелы, т.е. их удельные веса сравнимы с удельными весами твёрдых тел. Вблизи температур кристаллизации их теплоемкости и другие тепловые характеристики близки к соответствующим характеристикам твёрдых тел. В жидкостях наблюдается до известной степени правильное расположение атомов, но лишь в малых областях. Здесь атомы тоже совершают колебательное движение возле узлов квазикpисталлической ячейки, но в отличие от атомов твёрдого тела они время от времени перескакивают от одного узла к другому. В результате движение атомов будет весьма сложным: оно колебательное, но вместе с тем центр колебаний перемещается в пространстве.
Газ, испарение, конденсация и плавление
Определение
Газ -- такое состояние вещества, в котором расстояния между молекулами велики.
Силами взаимодействия между молекулами при невысоких давлениях можно пренебречь. Частицы газа заполняют весь объем, который предоставлен газу. Газы можно рассматривать как сильно перегретые или ненасыщенные пары. Особым видом газа является плазма -- это частично ли полностью ионизированный газ, в котором плотности положительных и отрицательных зарядов практически одинаковы. Плазма представляет собой газ из заряженных частиц, которые взаимодействуют между собой с помощью электрических сил на большом расстоянии, но не имеют ближнего и дальнего расположения частиц.
Вещества могут переходить из одного агрегатного состояния в другое.
Определение
Испарение -- это процесс изменения агрегатного состояния вещества, при котором с поверхности жидкости или твердого тела вылетают молекулы, кинетическая энергия которых превышает потенциальную энергию взаимодействия молекул.
Испарение -- это фазовый переход. При испарении часть жидкости или твердого тела переходит в пар. Вещество в газообразном состоянии, находящееся в динамическом равновесии с жидкостью называется насыщенным паром. При этом изменение внутренней энергии тела:
\[\triangle \ U=\pm mr\ \left(1\right),\]
где m -- масса тела, r -- удельная теплота парообразования (Дж/кг).
Определение
Конденсация -- процесс, обратный парообразованию.
Расчет изменения внутренней энергии происходит по формуле (1).
Определение
Плавление -- процесс перехода вещества из твердого состояния в жидкое, процесс изменения агрегатного состояния вещества.
Когда вещество нагревают увеличивается его внутренняя энергия, следовательно, увеличивается скорость теплового движения молекул. В том случае, если достигнута температура плавления вещества, то кристаллическая решетка твердого тела начинает разрушаться. Связи между частицами разрушаются, возрастает энергия взаимодействия между частицами. Теплота, передаваемая телу, идет на увеличении внутренней энергии этого тела, и часть энергии идет на совершение работы по изменению объема тела при его плавлении. У большинства кристаллических тел объем увеличивается при плавлении, но есть исключения, например, лед, чугун. Аморфные тела не имеют определенной температуры плавления. Плавление является фазовым переходом, который сопровождается скачкообразным изменением теплоемкости при температуре плавления. Температура плавления зависит от вещества и она не изменяется в ходе процесса. При этом изменение внутренней энергии тела:
\[\triangle U=\pm m\lambda \left(2\right),\]
где $\lambda $ -- удельная теплота плавления (Дж/кг).
Процесс обратный плавлению - кристаллизация. Расчет изменения внутренней энергии происходит по формуле (2).
Изменение внутренней энергии каждого тела системы в случае нагревания или охлаждения можно рассчитать по формуле:
\[\triangle U=mc\triangle T\left(3\right),\]
где c - удельная теплоемкость вещества, Дж/(кгК), $\triangle T$- изменение температуры тела.
При изучении переходов веществ из одних агрегатных состояний в другие невозможно обойтись без так называемого уравнения теплового баланса , которое гласит: суммарное количество теплоты, которое выделяется в теплоизолированной системе, равно количеству теплоты (суммарному), которое в этой системе поглощается.
По своему смыслу, уравнение теплового баланса -- это закон сохранения энергии для процессов теплообмена в термоизолированных системах.
Пример 1
Задание: В теплоизолированном сосуде находятся вода и лед при температуре $t_i= 0^oС$. Масса воды ($m_{v\ })$ и льда ($m_{i\ })$ соответственно равны 0,5 кг и 60 гр. В воду впускается водяной пар массой $m_{p\ }=$10 гр. при температуре $t_p= 100^oС$. Какой станет температура воды в сосуде после установления теплового равновесия? Теплоемкость сосуда не учитывать.
Решение: Определим, какие процессы происходят в системе, какие агрегатные состояния вещества мы имели и какие получили.
Водяной пар конденсируется, отдавая тепло.
Это тепло идет на плавление льда и, возможно, нагрев имеющейся и полученной изо льда воды.
Проверим сначала, какое количество теплоты выделяется при конденсации имеющейся массы пара:
здесь из справочных материалов имеем $r=2,26 10^6\frac{Дж}{кг}$- удельная теплота парообразования (применима и для конденсации).
Для плавления льда необходимо тепла:
здесь из справочных материалов имеем $\lambda =3,3\cdot 10^5\frac{Дж}{кг}$- удельная теплота плавления льда.
Получаем, что пар отдает тепла больше, чем требуется, только для расплавления имеющегося льда, следовательно уравнение теплового баланса запишем в виде:
Теплота выделяется при конденсации пара массой $m_{p\ }$ и остывании воды, которая образуется из пара от температуры $T_p$ до искомой T. Теплота поглощается при плавлении льда массой $m_{i\ }$ и нагревании воды массой $m_v+m_i$ от температуры $T_i$до $T.\ $ Обозначим $T-T_i=\triangle T$, для разности $T_p-T$ получим:
Уравнение теплового баланса приобретет вид:
\ \ \[\triangle T=\frac{rm_{p\ }+cm_{p\ }100-лm_{i\ }}{c\left(m_v+m_i+m_{p\ }\right)}\left(1.6\right)\]
Проведем вычисления, учитывая, что теплоемкость воды табличная $c=4,2\cdot 10^3\frac{Дж}{кгК}$, $T_p=t_p+273=373K,$ $T_i=t_i+273=273K$:
$\triangle T=\frac{2,26\cdot 10^6\cdot 10^{-2}+4,2\cdot 10^3\cdot 10^{-2}10^2-6\cdot 10^{-2}\cdot 3,3\cdot 10^5}{4,2\cdot 10^3\cdot 5,7\cdot 10^{-1}}\approx 3\left(К\right)$тогда T=273+3=276 (K)
Ответ: Температура воды в сосуде после установления теплового равновесия станет равна 276 К.
Пример 2
Задание: На рисунке показан участок изотермы, отвечающий переходу вещества из кристаллического в жидкое состояние. Что соответствует этому участку на диаграмме p,T?

Вся совокупность состояний, изображенных на диаграмме p,V горизонтальным отрезком прямой на диаграмме p,T изображается одной точкой, определяющей значения p и T, при которых осуществляется переход из одного агрегатного состояния в другое.
Любое тело может находиться в разных агрегатных состояниях при определенных температуре и давлении - в твердом, жидком, газообразном и плазменном состояниях.
Для перехода из одного агрегатного состояния в другое происходит при условии, что нагревание тела из вне происходит быстрее, чем его охлаждение. И наоборот, если охлаждение тела из вне происходит быстрее, чем нагрев тела за счет его внутренней энергии.

При переходе в другое агрегатное состояние вещество остается прежним, останутся те же молекулы, изменится только их взаимное расположение, скорость движения и силы взаимодействия друг с другом.
Т.е. изменение внутренней энергии частиц тела переводит его из одной фазы состояния в другую. При этом это состояние может поддерживаться в большом температурном интервале внешней среды.
При изменении агрегатного состояния нужно определенное количество энергии. И в процессе перехода энергия тратится не на изменение температуры тела, а на изменение внутренней энергии тела.
Отобразим на графике зависимость температуры тела T (при постоянном давлении) от количества подаваемого к телу тепла Q при переходе из одного агрегатного состояния в другое.

Рассмотри тело массой m , которое находится в твердом состоянии с температурой T 1 .
Тело переходит не моментально из одного состояния в другое. Сначала нужна энергия на изменение внутренней энергии, а на это нужно время. Скорость перехода зависит от массы тела и его теплоёмкости.
Начнем нагревать тело. Через формулы можно записать так:
Q = c⋅m⋅(T 2 -T 1)
Столько тепла тело должно усвоить, чтобы нагреться с температуры T 1 до T 2 .
Переход твердого тела в жидкое
Далее при критической температуре T 2 , которая для каждого тела своя, начинают рушиться межмолекулярные связи и тело переходит в другое агрегатное состояние - жидкость, т.е. межмолекулярные связи слабеют, молекулы начинаю перемещаться с большей амплитудой с большей скоростью и большей кинетической энергией. Поэтому температура одного и того же тела в жидком состоянии выше, чем в твердом.
Для того чтобы всё тело перешло из твердого состояния в жидкое, нужно время на накопление внутренней энергии. В это время вся энергия идет не на нагрев тела, а на разрушение старых межмолекулярных связей и создание новых. Количество энергии нужно:
λ - удельная теплота плавления и кристаллизации вещества в Дж/кг, для каждого вещества своя.
После того как всё тело перешло в жидкое состояние, эта жидкость опять начинает нагреваться по формуле: Q = c⋅m⋅(T-T 2); [Дж].
Переход тела из жидкого состояния в газообразное
При достижении новой критической температуры Т 3 , начинается новый процесс перехода из жидкого состояния в парообразный. Чтобы дальше перейти из жидкости в пар, нужно затратить энергии:
r - удельная теплота газообразования и конденсации вещества в Дж/кг, для каждого вещества своя.
Заметим, что возможен переход из твердого состояния в газообразное состояние, минуя жидкую фазу. Такой процесс именуется возгонкой , а обратный ему процесс - десублимацией .
Переход тела из газообразного состояния в плазменное
Плазма - частично или полностью ионизированный газ, в котором плотности положительных и отрицательных зарядов практически одинаковы.
Плазма обычно возникает при высокой температуре, от нескольких тысяч °С и выше. По способу образования различают два вида плазмы: термическую, возникающую при нагревании газа до высоких температур, и газообразную, образующуюся при электрических разрядах в газовой среде.
Этот процесс очень сложный и имеет простого описания, да и нам в бытовых условиях он не достижим. Поэтому не будем подробно останавливаться на этом вопросе.